Электрохимические методы анализа состояния биологических объектов, их выделений и проб основаны на использовании явлений и процессов, протекающих на электродах или в межэлектродном пространстве.
При медицинских исследованиях из электрохимических обычно применяются методы потенциометрии, кондуктометрии и вольтамперометрии. Потенциометрические методы
Потенциометрическими называются методы, в которых измеряются потенциалы, имеющиеся у электрода, помещенного в исследуемую среду, относительно второго электрода сравнения, помещенного в ту же среду.
Электродным потенциалом называется потенциал электрода относительно раствора, в который он погружен. Значение его и полярность зависят от материала электрода и состава раствора. При малой концентрации раствора в него могут переходить положительно заряженные ионы металла. Раствор заряжается положительно, а на электроде остаются избыточные электроны. Он имеет отрицательный потенциал относительно раствора. Происходит восстановление электрода.
Если концентрация раствора большая, то положительные ионы могут, наоборот, выделяться на электроде и заряжать его положительно относительно раствора. Происходит окисление электрода. Считается, что в растворах электрические заряды переносятся ионами и ионная проводимость на поверхности электродов переходит в электронную. По металлическим проводникам электрические заряды переносятся электронами.
Значение электродного потенциала с помощью электрических методов непосредственно измерить невозможно. В раствор необходимо ввести второй электрод, который относительно него будет иметь свой электродный потенциал. Он должен быть выполнен так, чтобы его электродный потенциал относительно любого раствора имел бы одинаковую величину. Электродный потенциал этого электрода сравнения должен быть устойчив, воспроизводим и независим от состава раствора. Он не должен меняться при протекании небольших электрических токов.
При потенциометрии измеряются не электродные потенциалы, а их разность, имеющаяся между двумя электродами, погруженными в раствор. Один электродный потенциал постоянен, а второй для конкретных электрода и раствора зависит от концентрации определяемого вещества. Благодаря этому обстоятельству имеется возможность определять концентрацию ионов различных веществ в электролитах путем измерения разности потенциалов между электродом, который называют индикаторным или измерительным, и электродом сравнения.
Потенциометрические приборы
Потенциометрические приборы, предназначенные для измерения концентрации различных ионов, начинаются ионометрами.
Ионометры, с помощью которых и измеряется концентрация водородных ионов (рН), называются рН-метрами..
Эффективность ионометрии, в первую очередь, зависит от качества электрода сравнения и измерительного.
В качестве электрода сравнения чаще всего используются хлорсеребряный электрод (хлоридосеребряный) и каломельный.
В хлорсеребряном электроде серебряная проволока, покрытая слоем хлорида серебра, погружена в раствор хлорида калия 4. Обычно используется насыщенный раствор КСl, поскольку активность хлорид-ионов в насыщенном растворе при постоянной температуре имеет постоянное значение. Наблюдается окислительно-восстановительная полуреакция.
Благодаря микроскопическому отверстию 3 обеспечивается электрический контакт между внутренним 4 и внешним растворами КСl 2. Через асбестовое волокно 1 внешний раствор 2 электрически контактирует с исследуемым раствором. Считается, что потенциал хлорсеребряного электрода (относительно стандартного водородного потенциала) равен 0,222 В и воспроизводится с погрешностью ±0,02 мВ .
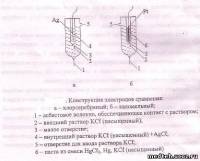
В каломельном электроде используется окислительно-восстановительная полуреакция:
Hg2Cl2 + 2e- = 2Hg + 2Cl
Потенциал электрода зависит от активности хлорид-ионов в растворе, контактирующем с пастой 6, состоящей из металлической ртути и каломели Нg2Сl2. Обычно используется насыщенный раствор хлорида калия. Потенциал насыщенного каломельного электрода (относительно стандартного водородного электрода) равен 0,242 В и воспроизводится с погрешностью ±0,01 мВ. Проволока контакта выполняется из платины.
Показанные на рис. электроды называют электродами с двойным солевым мостиком, так как для их изготовления используются два раствора -внутренний, с постоянной концентрацией ионов, определяющих потенциал, и внешний, который необходим для уменьшения диффузного потенциала. Диффузный потенциал возникает в месте соприкосновения различающихся по составу растворов и обусловлен различием скоростей, с которыми ионы пересекают жидкостную границу. Он может достигать нескольких десятков мВ, что при отсутствии соответствующих мер компенсации вызовет появление существенной Погрешности. Солевые мостики между растворами позволяют существенно снизить влияние диффузного потенциала.
Электроды сравнения называются электродами II рода. Их потенциал обратимо зависит от активности ионов, образующих малорастворимые соединения.
Измерительные электроды для потенциометрических измерений могут быть металлическими и мембранными (ионоселективными).
Активные измерительные металлические электроды изготавливают из металлов Аg, Сu, Сd, РЬ, Аu, Рt, образующих восстановленную форму обратимой окислительно-восстановительной полуреакции. Любой из таких электродов в растворе, содержащем ионы, приобретает потенциал, обратимо изменяющийся в зависимости от концентрации вещества. Электроды, потенциал которых зависит от активности ионов в растворе, называют электродами I рода.
Для медико-биологических исследований большую роль играют мембранные или ионоселективные электроды. Характерной их особенностью является наличие полупроницаемой мембраны. Это пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого раствора. В одних случаях мембраны проницаемы для ионов только одного сорта в присутствии ионов другого сорта. В других - они пропускают ионы только определенного знака (анионы или катионы).
Самостоятельную группу составляют недавно созданные ферментные электроды. Это ионоселективные электроды, покрытые слоем фермента, вызывающего реакцию органического или неорганического вещества. В итоге образуются частицы (ионы, молекулы), характеризуемые появлением отклика у электрода. Так как фермент обычно катализирует только один тип реакции, то селективность у ферментных электродов очень высокая.
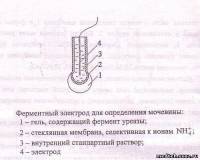
Внутреннее сопротивление у стеклянных электродов достигает 1000 МОм. Поэтому входные сопротивления у измерителей разности потенциалов должны быть порядка 1012 Ом. При его оценке широко применяются компенсационные методы измерений.




 Российская Федерация
Российская Федерация







 познавательский, лабораторным не занимаюсь, но пригодится. evven,
познавательский, лабораторным не занимаюсь, но пригодится. evven, 
